|

Важным понятием в химической кинетике является порядок реакций. Он характеризуется суммой показателей степеней концентраций отдельных реагентов в выражении закона действия масс. Различают реакции первого, второго, третьего порядка. Порядок реакции не всегда совпадает с ее молекулярностью. Большинство химических реакций протекает в несколько стадий и скорость реакции характеризуется скоростью наиболее медленно протекающей стадии. Порядок реакции будет выражаться молекулярностью этой стадии и, как правило, отличаться от суммы коэффициентов реакции в целом. Так, в реакциях гидролиза солей в разбавленных водных растворах концентрация воды изменяется так незначительно, что в уравнение скорости реакции она не входит, и кинетика таких реакций будет описываться уравнениями кинетики реакций первого порядка. Реакции разложения молекул, внутримолекулярных группировок (например, диссоциация молекулы хлора на атомы) являются одномолекулярными и относятся к реакциям первого порядка. Скорость одномолекулярной реакции выражается уравнением
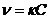 (4) (4)
Согласно уравнению 4
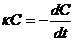 (5) (5)
где k имеет размерность l/t, или
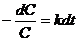 (6) (6)
После интегрирования получаем
lnC=-kt+B (7)
Если начальную концентрацию принять за С0, то можно определить постоянную интегрирования: В=lnC0.
Отсюда
ln(C/C0)=-kt (8)
C=C0e-kt (9)
Это уравнение характеризует зависимость концентрации от времени для химических реакций первого порядка. Так как в уравнение концентрация вещества входит в виде отношения, то константа скорости реакции первого порядка не будет зависеть от размерности времени. При изменении обеих концентраций в одинаковое число раз интервал времени не будет изменяться, т. е. за одни и те же промежутки времени будет реагировать одна и та же часть взятого количества исходного вещества. Если в первую минуту прореагировала 1/100 часть от общего количества исходного вещества, то через минуту прореагирует столько же от оставшихся 99 частей исходного вещества.
Кинетика реакции второго порядка для равенства концентраций реагирующих веществ описывается уравнением
kt= (C0-C)/C0C (10)
Если учитывать изменение концентрации реагирующего вещества по времени t, x=C0—С, то t/x=C0—С. Тогда уравнение принимает вид
k = x/tC0(C0 — x) (11)
В отличие от реакций первого порядка величина х в уравнении будет зависеть от того, в каких единицах выражаются время и концентрация реагирующих веществ.
|