|

Материалы » Шпаргалки по экологической токсикологии » Зависимость токсичности химических органических веществ от
входящих в состав вещества химических группировок и атомов.
Введение молекул атомов галогенов приводит к резкому увеличению численности. Атом хлора и фтора в молекуле углеводорода усиливает его химическую активность, увеличивает растворимость вещества в воде, увеличивает способность окислять многие биомолекулы путем дегидрирования. При этом увеличивается токсичность вещества. Сами галогены: F2, Cl2, Br2, I2 проявляют определенную токсичность.
Токсичность уменьшается в направлении слева направо. В тоже время атомная масса от F2 к I2 увеличивается, проявление токсичности имеет величина электрического заряда и размер атомов галогена. Сильно электроотрицательный атом фтора отличается высокой подвижностью и поэтому более реакционно-способный.
Важную роль играет местоположение атома галогена в молекуле. Эти положения можно иллюстрировать сравнением линейных и циклических УВ: |
С – С – С – С –> Cl
подвижность |
 неподвижность неподвижность
|
Чем больше атомов хлора в молекуле, тем токсичность возрастает. Имеет значение местоположение атомов хлора в молекуле. |
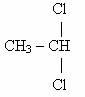 1,1-дихлорэтан 1,1-дихлорэтан
|
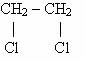
1,2-дихлорэтан |
Эти соединения действуют как наркотические вещества. Включение атомов галогенов ведет к возрастанию токсичности. |
CH4 –> |
CHCl3 –>
Наркотическое вещество
хлороформ |
CCl4
Тетрахлорметан
Более токсичен |
Если в молекулу этилового спирта ввести 3 атома брома, образуется C2H2Br3OH (нарколан), который токсичен в 10 раз. Следовательно, одной из главных молекулярных характеристик, определяющих токсичность веществ, является энергия химической связи.
Токсичность увеличивается в ряду УВ с ведением в молекулу галогенов от фтора к йоду. Наибольшая энергия связи C-галоген характерна для C-F, C-Cl, C-Br и C-I. Токсичность химических веществ во многом зависит от поведения их в организме (биохимические связи). В числе сильных синтетических ядов – производные фторкарбоновых кислот, имеются как слабо токсичные F-(CH2)n-COOH, но среди них есть неопасные. Они ядовиты, когда n-нечетное число, а когда n-четное, вещества не обладают токсичным действием. Изменение токсичности связано с теорией В-окисление органических кислот. F-(CH2)n-CH2-COOH. Если n-нечетное число, то образуется высокотоксичная фторуксусная кислота. Если n-четное – нетоксичная фторпропионовая кислота.
В противоположном галогенам элементе S не обладает токсичностью, но если атом серы ввести в молекулу УВ и превратить его в меркапто-соединение, то она станет более токсичной. Если в молекулу гексана ввести атом серы, то его токсичность увеличится в 25 раз, а если в молекулу октана, то в 350 раз.
C6H15SH <— C6H14
C8H17SH <— C8H18
Было установлено, что такая модификация молекулы органических веществ облегчает взаимодействие и увеличивает прочность их связи с белковой частью клеточных мембран (через образования дисульфидных мостиков).
Большую роль в проявлении токсичности играет валентность серы. 6-валентная сера – нетоксична. Однако 2-валентная сера в составе органического соединения наиболее токсичная.
|